Химичният символ на кислорода е само началната буква на латинското му наименование — O. Кислородният атом може да образува две връзки. Свързва се с два водородни атома и образува вода. Освен това може да заеме две от четирите връзки на един въглероден атом, а останалите две да се заемат от друг кислороден атом. По този начин се образува въглероден двуокис.
Да предположим, че един кислороден атом с едната си връзка се свързва с един въглероден атом, а с другата — с един водороден атом. Комбинацията от атоми ще изглежда по следния начин: C–O–H.
Всяка молекула, която съдържа такава комбинация, се нарича алкохол. Тази дума произлиза от арабски и ни напомня, че през ранното средновековие арабите (и изобщо мюсюлманският свят) са били много по-напред от Европа в науката.
Молекулата на най-простия алкохол съдържа само един въглероден атом:
Тъй като в нея има метилова група, съединението се нарича метилов алкохол.
Метиловият алкохол се различава от метана, защото един водороден атом от метана е заместен от комбинацията кислород-водород. (Тази комбинация O–H се нарича хидроксилна група.)
Каква разлика създава този допълнителен кислороден атом!
Наличието на хидроксилна група в една молекула придава на съединението електрични свойства, наподобяващи тези на водата. Това означава, че докато метанът не е разтворим във вода, метиловият алкохол се разтваря. В действителност метиловият алкохол и водата се смесват във всякакво отношение, така че като гледате сместа, никога не бихте казали, че се състои от две различни течности.
Наличието на хидроксилна група променя и температурата на кипене на съединението. Електричните свойства на хидроксилните групи са такива, че молекулите, които ги съдържат, се „прилепват“ леко една към друга. Молекулите на течния метан, които не съдържат хидроксилни групи, не се прилепват една към друга. Те лесно се отделят във вид на пари. Дори при смразяващата температура от –161°C има достатъчно налична топлина, която да доставя енергията за изпаряване на метана. Следователно –161°C е температурата на кипене на метана. Всяка молекула метилов алкохол обаче има хидроксилна група, която го прави „прилепчив“. За да се раздалечат тези молекули и да се превърнат в пари, е необходимо значително количество енергия, въпреки че молекулите не са много по-големи от тези на метана. Ето защо температурата на кипене на метиловия алкохол е 65°C — с 226°C по-висока от температурата на кипене на метана.
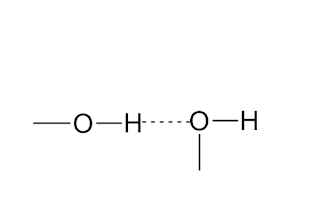
Когато две хидроксилни групи се „прилепят“ една към друга, образуват водородна връзка. Тя може да се напише по следния начин:
Да предположим, че един кислороден атом с едната си връзка се свързва с един въглероден атом, а с другата — с един водороден атом. Комбинацията от атоми ще изглежда по следния начин: C–O–H.
Всяка молекула, която съдържа такава комбинация, се нарича алкохол. Тази дума произлиза от арабски и ни напомня, че през ранното средновековие арабите (и изобщо мюсюлманският свят) са били много по-напред от Европа в науката.
Молекулата на най-простия алкохол съдържа само един въглероден атом:
Тъй като в нея има метилова група, съединението се нарича метилов алкохол.
Метиловият алкохол се различава от метана, защото един водороден атом от метана е заместен от комбинацията кислород-водород. (Тази комбинация O–H се нарича хидроксилна група.)
Каква разлика създава този допълнителен кислороден атом!
Наличието на хидроксилна група в една молекула придава на съединението електрични свойства, наподобяващи тези на водата. Това означава, че докато метанът не е разтворим във вода, метиловият алкохол се разтваря. В действителност метиловият алкохол и водата се смесват във всякакво отношение, така че като гледате сместа, никога не бихте казали, че се състои от две различни течности.
Наличието на хидроксилна група променя и температурата на кипене на съединението. Електричните свойства на хидроксилните групи са такива, че молекулите, които ги съдържат, се „прилепват“ леко една към друга. Молекулите на течния метан, които не съдържат хидроксилни групи, не се прилепват една към друга. Те лесно се отделят във вид на пари. Дори при смразяващата температура от –161°C има достатъчно налична топлина, която да доставя енергията за изпаряване на метана. Следователно –161°C е температурата на кипене на метана. Всяка молекула метилов алкохол обаче има хидроксилна група, която го прави „прилепчив“. За да се раздалечат тези молекули и да се превърнат в пари, е необходимо значително количество енергия, въпреки че молекулите не са много по-големи от тези на метана. Ето защо температурата на кипене на метиловия алкохол е 65°C — с 226°C по-висока от температурата на кипене на метана.
Когато две хидроксилни групи се „прилепят“ една към друга, образуват водородна връзка. Тя може да се напише по следния начин:
Където с точки е отбелязана водородната връзка. (Комбинации от други атоми също могат да се прилепват една към друга по този начин.) Здравината на водородните връзки е само 5% от тази на обикновените връзки, но те са изключително важни. Огромните молекули на някои от сложните вещества в нашия организъм не се разпадат благодарение на водородните връзки, които обединяват отделните им части.
Един от старите методи за добиване на метилов алкохол се състоеше в нагряване на дърва в отсъствието на въздух. В резултат на нагряването сложните молекули в дървесината се разпадат на по-малки. Тези по-малки молекули се отделят под формата на пари. Парите не горят поради липсата на въздух. Те се събират, втечняват и по този начин се добиват някои вещества, включително и метилов алкохол. Поради този начин на добиване метиловият алкохол е известен като дървесен спирт.
Думата метил също е свързана с този процес. Тя произлиза от гръцки и означава „дървесно вино“. Тъй като метил се отнася за алкохол с един въглероден атом в молекулата, наименованието „метан“ е дадено на този въглеводород, който е също с един въглероден атом в молекулата.
Метиловият алкохол има промишлено значение като изходно вещество за получаването на по-сложни молекули. Той има и друго приложение, което се нуждае от известно обяснение.
Твърдите вещества реагират много бавно. Когато работят с твърди вещества, обикновено химиците се стараят да ускорят реакциите. Това е особено важно за заводите, където се борави с тонове материал. За да се ускори работата, твърдият материал се разтваря в течност. В разтвор реакцията протича много бързо.
Въпросът е да се намери течност, която да разтвори дадените твърди материали; с други думи, да се намери съответният разтворител. Много от твърдите вещества се разтварят във вода и водата е най-важният разтворител, с който разполагаме. Обаче много от органичните твърди вещества не се разтварят във вода, а в определени органични течности. Поради това тези органични течности също са важни разтворители.
За да бъдат наистина полезни, разтворителите трябва да бъдат достъпни в големи количества и евтини. Температурата им на кипене трябва да е достатъчно ниска, за да могат да бъдат лесно изпарени, когато вече не са нужни.
Метиловият алкохол с температура на кипене 65°C е пример за отличен разтворител за промишлеността. Друг важен разтворител за промишлеността впрочем е бензолът, но има и много други. Всеки разтворител е ценен посвоему. Някои твърди вещества се разтварят в един разтворител, но не и в друг; дадена реакция може да протича добре в един разтворител, но не и в друг. Химикът в производството, където се работи с тонове химикали, трябва да бъде така внимателен при подбора на компонентите, както майсторът сладкар при приготвянето на сватбена торта.
|
"Въглерод и Здраве" ===================== |